Entschlüsselung der Rolle von Synphilin-1 bei der Alpha-Synuclein-Pathologie – Prof. Dr. Tiago F. Outeiro

Hintergrund und Ziel der Studie
Ein Merkmal neurodegenerativer Erkrankungen wie Parkinson ist die Ansammlung von Proteinablagerungen im Gehirn. Diese bestehen hauptsächlich aus dem Protein Alpha-Synuclein (aSyn), einem kleinen Protein, das als normaler Bestandteil in den Nervenzellen vorkommt und unter anderem die Dopamin-Ausschüttung reguliert.
- Forschungsleitung:
Prof. Dr. Tiago F. Outeiro, Direktor der Abteilung Experimentelle Neurodegeneration an der Universitätsmedizin Göttingen (UMG) - Studie:
Entschlüsselung der Rolle von Synphilin-1 in der Pathologie von Alpha-Synuclein - Dauer:
1 Jahr
Ziel der Studie: Die Erforschung von Mechanismen der Pathologie-Ausbreitung und -Progression der Parkinson-Erkrankung sowie die Entdeckung neuer Biomarker, die sowohl die Forschung nach einer akkuraten und frühzeitigen Diagnose unterstützen als auch zur Entwicklung neuer Therapien führen könnten.
Ablagerungen des Proteins Alpha-Synuclein (aSyn): Ursache für die Parkinson-Krankheit?
Es wird angenommen, dass die Ablagerungen von aSyn in den Lewy-Körperchen — das sind Einschlüsse im Zytoplasma von Nervenzellen, die aus abnorm phosphorylierten Proteinen bestehen — für das Absterben der Hirnzellen verantwortlich und damit die Ursache der neurodegenerativen Erkrankungen sind.
Doch das Protein Synphilin-1 (Sph1) beeinflusst die Akkumulation von aSyn.
Prof. Outeiro geht davon aus, dass die Eiweißablagerungen neben aSyn noch diverse andere Proteine wie z. B. Synphilin-1 (Sph1) enthalten, welches die Akkumulation von aSyn beeinflusst. In seiner Studie wird er untersuchen, welche Rolle Sph1 bei der Akkumulation und Verbreitung von aSyn spielt und ob es auch das Ausbreiten der mit aSyn assoziierten krankhaften Veränderungen beeinflusst.
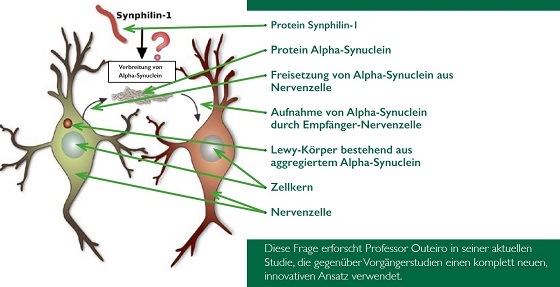
Entschlüsselung der Rolle von Synphilin-1 in der Pathologie von Alpha-Synuclein Trotz vorangegangener Forschung bleibt unklar: Ist Synphilin-1 (Sph1) für die Ausbreitung der Pathologie von Alpha-Synuclein (aSyn) auf benachbarte Nervenzellen verantwortlich?
Das Ziel: Neue Therapien durch die Untersuchung der Proteine und ihrer Wechselwirkung
Ziel der Studie ist es, die Mechanismen der Pathologie- Ausbreitung und -Progression der Parkinson-Erkrankung zu erkennen und neue Biomarker zu erhalten, welche sowohl die Forschung nach einer akkuraten und frühzeitigen Diagnose unterstützen als auch zur Entwicklung neuer Therapien führen könnten.
Entschlüsselung der Rolle von Synphilin-1 bei der Alpha-Synuclein-Pathologie
Die Parkinson-Krankheit (PD) ist eine neurodegenerative Erkrankung, die durch typische motorische Manifestationen gekennzeichnet ist. Die Pathologie ist mit dem Verlust von Neuronen (dopaminerge Neuronen genannt) in einer bestimmten Hirnregion (der Substantia Nigra, SN) – und der Anhäufung von Alpha-Synuclein (aSyn; ein Protein, das im Gehirn reichlich vorhanden ist) in Ablagerungen (sogenannte Lewy-Körperchen) verbunden.
Neuere Studien unterstützen die Idee, dass sich aSyn von Neuron zu Neuron ausbreiten kann. Die molekularen Mechanismen, die diesem Phänomen zugrunde liegen, sind jedoch noch nicht vollständig verstanden und bleiben umstritten. Synphilin-1 (Sph1) ist ein enger Partner von aSyn. Es verstärkt die Akkumulation zytoplasmatischer Einschlüsse von aSyn und ist auch in Lewy-Körpern vorhanden. Sph1 wird in Neuronen, einschließlich der Neuronen der SN, exprimiert und ko-lokalisiert mit aSyn an präsynaptischen Nervenendungen.
In dieser Studie untersuchten wir, ob die intrazelluläre Akkumulation von aSyn, die durch Sph1 gefördert wird, die Freisetzung von aSyn reduzieren und dadurch die Ausbreitung der Pathologie behindern könnte. Wir erstellten ein Modell, das die Bildung von aSyn-Ablagerungen im Zytoplasma imitiert, wenn aSyn und Sph1 interagieren (Abb.1). Dann fragten wir, ob die Bildung intrazellulärer Einschlüsse die Freisetzung von aSyn reduziert und ob wir diese Freisetzung modulieren können.
Abb.1. Protein-Interaktion. Die Interaktion der beiden Proteine führte zu einer zytosolischen Akkumulation, die von Filamenten umgeben sind.
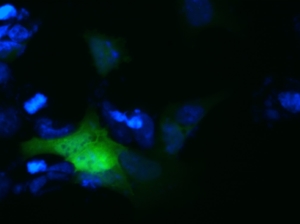
aSyn-aSyn
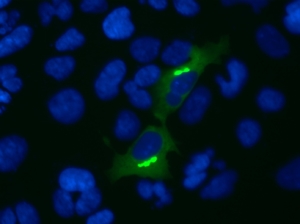
aSyn-Sph1
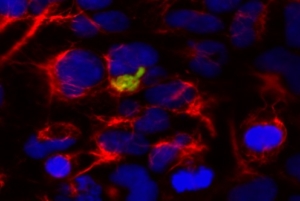
aSyn-Sph1, Filamentous
Wir beobachteten, dass die von aSyn-Sph1 gebildeten Einschlüsse von einem filamentösen Protein umgeben sind, das die Freisetzung von aSyn modulieren kann. Wir fanden heraus, dass es mindestens zwei Mechanismen gibt, die für die aSyn-Freisetzung in Zellen eine Rolle spielen:
- Die Akkumulation von aSyn bei der Interaktion mit Sph1
- Die Aufspaltung filamentöser Proteine
Zusammenfassend lässt sich sagen, dass diese Studie es uns ermöglichte, potenzielle Strategien und Ansätze für Interventionen zu identifizieren, die weiter erforscht werden können. Der Parkinson Fonds Deutschland gab uns eine entscheidende finanzielle Unterstützung, um die Rolle von Sph1 bei der Aggregation und Ausbreitung von aSyn zu verstehen.

 Spenden
Spenden