Fortschritte unserer Forschungsprojekte
Universitätsmedizin Göttingen (UMG): Studie mit dem Titel ‚Entschlüsselung der Rolle von Synphilin-1 in der Pathologie von Alpha-Synuclein‘ unter der Leitung von Prof. Dr. Tiago F. Outeiro, Direktor der Abteilung Experimentelle Neurodegeneration.
PROF. DR. TIAGO F. OUTEIRO
 • Studium der Biochemie an der Universität Porto/Portugal
• Studium der Biochemie an der Universität Porto/Portugal
• Doktorarbeit am Whitehead-Institut für biomedizinische Forschung (MIT), Cambridge/USA
• Wissenschaftlicher Mitarbeiter in der neurologischen Abteilung des MGH (Lehrkrankenhaus der Medizinischen Fakultät der Harvard University)
• Leitung der Abteilung für Molekulare und Zelluläre Neurowissenschaften am Institut für Molekulare Medizin (IMM) in Lissabon/Portugal
Hintergrund & Ziel der einjährigen Studie
Ein Merkmal neurodegenerativer Erkrankungen wie Parkinson ist der Verlust von dopaminergen Neuronen in der Hirnregion Substantia nigra sowie die Akkumulation (Anhäufung) des Proteins Alpha-Synuclein (aSyn) in Ablagerungen (sogenannte Lewy-Körperchen). Es wird angenommen, dass die Ablagerungen von aSyn in den Lewy-Körperchen – das sind Einschlüsse im Zytoplasma von Nervenzellen, die aus abnorm phosphorylierten Proteinen bestehen – für das Absterben der Hirnzellen verantwortlich und damit die Ursache der neurodegenerativen Erkrankungen sind. Neuere Studien unterstützen die Idee, dass sich aSyn von Neuron zu Neuron ausbreiten kann. Die molekularen Mechanismen, die diesem Phänomen zugrunde liegen, sind jedoch noch nicht vollständig verstanden und bleiben umstritten. Synphilin-1 (Sph1) ist ein enger Partner von aSyn. Es verstärkt die Akkumulation von Einschlüssen von aSyn im Zytoplasma (gesamter lebender Inhalt einer Zelle, der nach außen hin von der Zellmembran umschlossen wird) und ist auch in Lewy-Körpern vorhanden. Sph1 wird in Neuronen, einschließlich der Neuronen der Substantia nigra, exprimiert und ko-lokalisiert mit aSyn an präsynaptischen Nervenendungen.
Ablauf der Studie
In dieser Studie wurde untersucht, ob die intrazelluläre Akkumulation von aSyn, die durch Sph1 gefördert wird, die Freisetzung von aSyn reduzieren und dadurch die Ausbreitung der Pathologie behindern könnte. Es wurde ein Modell erstellt, das die Bildung von aSyn-Ablagerungen im Zytoplasma imitiert, wenn aSyn und Sph1 interagieren (Abb. 1). Dann wurde untersucht, ob die Bildung intrazellulärer Einschlüsse die Freisetzung von aSyn reduziert und ob diese Freisetzung moduliert werden kann.
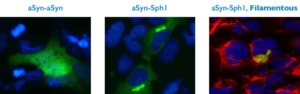
Abb.: Protein-Interaktion. Die Interaktion der beiden Proteine aSyn und Sph1 führte zu einer zytosolischen Akkumulation, die von Filamenten umgeben ist.
Vielversprechende Ergebnisse
In der Studie konnte beobachtet werden, dass die von aSyn-Sph1 gebildeten Einschlüsse von einem filamentösen (fadenförmigen) Protein umgeben sind, das die Freisetzung von aSyn modulieren kann. Es wurde erkannt, dass es mindestens zwei Mechanismen gibt, die für die aSyn-Freisetzung in Zellen eine Rolle spielen: die Akkumulation von aSyn bei der Interaktion mit Sph1 und die Aufspaltung filamentöser Proteine. Zusammenfassend lässt sich sagen, dass diese Studie es ermöglichte, wichtige potenzielle Strategien und Ansätze für neue Therapien zu identifizieren, die nun weiter erforscht werden können.
Spenden Sie für die Forschung
Spenden Sie jetzt für die Forschung zur Vorbeugung und Heilung der Parkinson-Krankheit.

 Spenden
Spenden